- Fuera de stock
Entregas 24/48 H (días hábiles)
Envios GRATIS desde 29.95 € (compra)
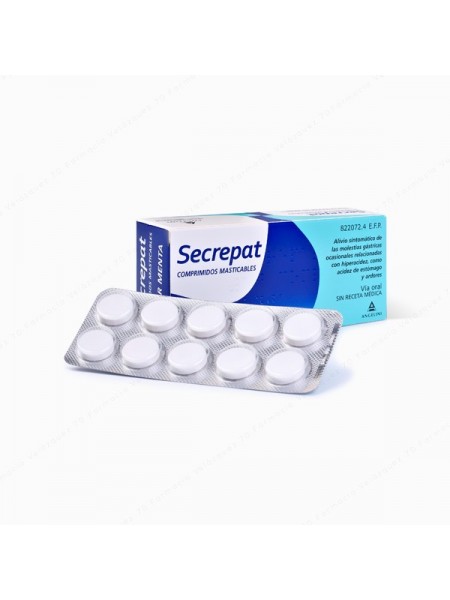
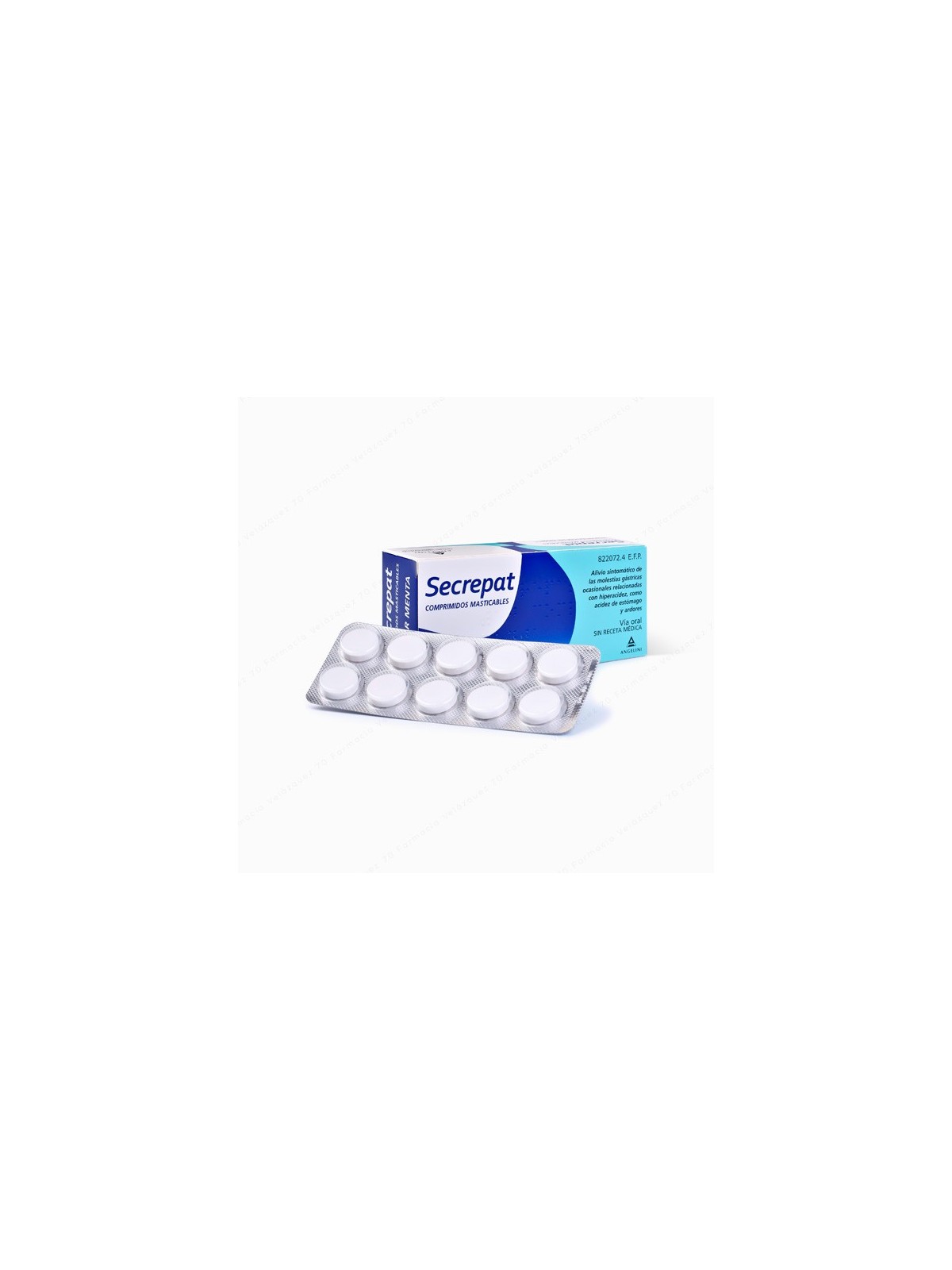
SECREPAT 50 COMPRIMIDOS MASTICABLES (SABOR ANIS)
Secrepat se utiliza para el alivio y tratamiento sintomático de la acidez y ardor de estómago en adultos y adolescentes mayores de 12
años
¿Tienes dudas? te ayudamos en el 976 73 46 08
ENVÍOS 4.95€ --- GRATIS a partir de 29.95 € (compra)
Entregas 24/48 H (días hábiles)
Pago 100% seguro - Métodos de pago: 
Secrepat se utiliza para el alivio y tratamiento sintomático de la acidez y ardor de estómago en adultos y adolescentes mayores de 12
años
Referencias específicas
1. NOMBRE DEL MEDICAMENTO
Secrepat comprimidos masticables sabor menta.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada comprimido masticable contiene 400 mg de aluminio glicinato, 150 mg de calcio carbonato, 100 mg
de aluminio hidróxido y 50 mg de magnesio trisilicato.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Comprimidos masticables con sabor a menta, de color blanco, redondos, biselados.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Alivio y tratamiento sintomático de la acidez y ardor de estómago en adultos y adolescentes mayores de 12
años.
4.2. Posología y forma de administración
Posología
Adultos y adolescentes mayores de 12 años: La dosis recomendada es de 1 ó 2 comprimidos masticables
cuando aparecen los síntomas y, preferiblemente, entre 20 minutos y 1 hora después de las comidas y antes
de acostarse.
No se debe exceder la dosis máxima de 8 comprimidos al día
Uso en pacientes con insuficiencia renal
No debe ser utilizado por pacientes con insuficiencia renal grave y se debe tener precaución en pacientes
con insuficiencia renal de leve a moderada (ver sección 4.3 Contraindicaciones y 4.4 Advertencias y
precauciones especiales de empleo).
Población pediátrica
No se ha establecido la seguridad de Secrepat en niños menores de 12 años.
Forma de administración
Este medicamento se toma vía oral.
Los comprimidos deben masticarse antes de tragarse.
No debe utilizarse durante más de 14 días seguidos. Si los síntomas empeoran o si persisten después de 14
días se evaluará la situación clínica del paciente.
4.3. Contraindicaciones
Hipersensibilidad a los principios activos o a alguno de los excipientes incluidos en la sección 6.1.
Pacientes con insuficiencia renal grave, ya que puede haber acumulación de los iones aluminio y
magnesio en el organismo.
Pacientes con hipermagnesemia o hipercalcemia.
Pacientes con obstrucción intestinal.
4.4. Advertencias y precauciones especiales de empleo
Si los síntomas empeoran, o si a pesar del tratamiento, persisten más de 14 días o recurren, se debe realizar
un examen clínico para eliminar el riesgo de una enfermedad subyacente grave, por ejemplo una úlcera
péptica o un proceso maligno.
No debe administrarse a niños menores de 12 años.
Se administrará con precaución en pacientes con dieta baja en fósforo, diarrea, malabsorción o trasplante
renal, ya que las sales de aluminio tienden a formar fosfatos insolubles en el intestino, disminuyendo su
absorción y excretándose en las heces. En estos enfermos, y sobre todo con tratamientos prolongados, se
puede provocar hipofosfatemia (anorexia, debilidad muscular, malestar general, etc.), osteomalacia,
osteoporosis y fracturas, sobre todo en pacientes con otras enfermedades óseas.
Los pacientes con insuficiencia renal de leve a moderada (aclaramiento de creatinina ≥ 30 ml/min), deben
tomar este medicamento con precaución: Se deben evitar las dosis altas en este tipo de pacientes ya que
existe el riesgo de intoxicación por hipermagnesemia e hiperaluminemia.
Tratamientos crónicos en este tipo de pacientes pueden dar lugar a encefalopatías (intoxicación por
aluminio) o hipermagnesemia.
En general, la administración de dosis altas durante periodos muy largos de tiempo puede producir
reacciones adversas como hipermagnesemia, hipercalcemia, hiperaluminemia y alcalosis metabólica.
No se recomienda el uso de antiácidos que contienen aluminio en pacientes con la enfermedad de
Alzheimer. Las investigaciones sugieren que el aluminio puede contribuir al desarrollo de la enfermedad,
ya que se ha demostrado que se concentra en la maraña de neurofibrillas del tejido cerebral.
Se evaluará la relación beneficio-riesgo en las siguientes situaciones clínicas:
Pacientes que presenten apendicitis o síntomas de apendicitis, ya que los efectos laxantes o astringentes
pueden aumentar el peligro de perforación o ruptura.
Pacientes con ileostomía o colostomía ya que aument el riesgo de desequilibrio de líquidos o de
electrolitos.
Pacientes con estreñimiento o impactación fecal, ya que pueden exacerbarse.
Pacientes con obstrucción del píloro.
Pacientes con hemorroides, ya que pueden exacerbarse.
Paciente con hipoparatiroidismo, ya que puede disminuir la excreción del calcio.
Pacientes con sarcoidosis, ya que aumenta el riesgo de hipercalcemia o de enfermedad renal.
Pacientes con hemorragia gastrointestinal o rectal no diagnosticada, diverticulitis, enfermedad
inflamatoria intestinal, cálculos renales de calcio, o que ingieran habitualmente grandes cantidades de
alcohol.
Advertencias sobre excipientes
Este medicamento contiene menos de 23 mg de sodio (1mmol) por comprimido; esto es, esencialmente
“exento de sodio”.
Interacción con pruebas diagnósticas:
El uso conjunto de antiácidos puede antagonizar los efectos de pentagastrin e histamina en la evaluación de
la función secretora de ácido gástrico. Por este motivo no se recomienda la administración de antiácidos en
la mañana que se va a realizar el test.
Este medicamento puede interferir con los valores fisiológicos de pruebas de laboratorio. Las
concentraciones séricas de calcio y gastrina pueden aumentar y las de potasio y fosfato pueden disminuir
cuando se administra esta especialidad.
El pH sérico y urinario puede aumentar con la ingesta de antiácidos.
4.5. Interacción con otros medicamentos y otras formas de interacción
Los antiácidos modifican la absorción o la excreción de otros medicamentos, por lo que se deberá separar
la toma de cualquier antiácido de otros medicamentos entre 2 y 3 horas, de manera que las posibles
interacciones puedan reducirse o evitarse.
No administrar conjuntamente este medicamento con tetraciclinas, fenotiazinas, digoxina, isoniazida,
fluorquinolonas, ketoconazol ni sales de hierro, ya que los antiácidos modifican la absorción o la excreción
de estos medicamentos. Se deberá espaciar la toma de estos medicamentos y el antiácido un mínimo de 2
horas.
Por su contenido en calcio la administración conjunta con fosfato sódico de celulosa puede dar lugar a la
disminución de la eficacia del fosfato sódico de celulosa en la prevención de hipercalciuria.
Por su contenido en magnesio la administración conjunta de este medicamento con fosfato sódico de
celulosa puede dar lugar a la unión del magnesio, se debe advertir a los pacientes que no tomen este
medicamento en la hora anterior o posterior a la toma del fosfato sódico de celulosa.
No administrar conjuntamente con mecamilamina o metenamina ya que puede disminuir la eficacia de
estos medicamentos.
No administrar conjuntamente con poliestireno sulfonato de sodio ya que puede verse afectada la
neutralización del ácido gástrico, dando lugar a una posible alcalosis sistémica.
Interacción con alimentos
Por su contenido en calcio carbonato, el tratamiento simultáneo y prolongado de este medicamento junto
con la ingesta de leche o productos lácteos puede dar lugar al síndrome "leche y alcalinos" (hipercalcemia y
alcalosis metabólica).
4.6. Fertilidad, embarazo y lactancia
Embarazo
La administración de antiácidos durante el embarazo se considera en general segura, pero su administración
de forma prolongada o a altas dosis está contraindicada por la posible acción sistémica.
Aunque no se han realizado estudios bien controlados en humanos, se ha reportado casos de reacciones
adversas como hipercalcemia, hipomagnesemia, hipermagnesemia y aumento de los reflejos tendinosos en
el feto y/o neonatos nacidos de madres que tomaron de forma crónica antiácidos de aluminio, calcio y/o
magnesio especialmente a altas dosis.
Lactancia
No se han detectado problemas en humanos. Cierta cantidad de calcio, aluminio y magnesio puede ser
excretada por la leche materna, pero a las dosis terapéuticas no se esperan efectos en los recien
nacidos/niños en periodo de lactancia.
Fertilidad
No se dispone de datos.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de este medicamento sobre la capacidad para conducir y utilizar máquinas, es nula o
insignificante.
4.8. Reacciones adversas
Las reacciones adversas se enumeran en orden decreciente de gravedad dentro de cada intervalo de
frecuencia, y se presentan agrupadas según su frecuencia en muy frecuentes (≥1/10); frecuentes (≥1/100 a
<1/10); poco frecuentes (≥1/1.000 a< 1/100); raras (≥1/10.000 a <1/1.000); muy raras (<1/10.000) y
frecuencia no conocida (no puede estimarse a partir de los datos disponibles).
Las reacciones adversas de Secrepat son en general leves y transitorias. Su perfil de seguridad es similar al
resto de antiácidos.
Los efectos astringentes del aluminio y el calcio se contrarrestan con los efectos laxantes del magnesio en
este preparado. No obstante, puede presentar las siguientes reacciones adversas:
Trastornos gastrointestinales:
Muy raros: modificaciones de la función intestinal (diarrea o estreñimiento).
Frecuencia no conocida: Fecaloma.
Trastornos del metabolismoy de la nutrición:
Frecuencia no conocida: hipermagnesemia, hiperaluminemia, hipercalcemia, hipofosfatemia, alcalosis
metabólica (también por insuficiencia renal).
Trastornos musculoesqueléticos y del tejido conjuntivo:
Frecuencia no conocida: osteoporosis, osteomalacia.
Trastornos vasculares:
Frecuencia no conocida: hinchazón de la parte inferior de las piernas.
Trastornos renales y urinarios
Frecuencia no conocida: cálculos renales.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite
una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales
sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de
Farmacovigilancia de Medicamentos de Uso Humano: www.notificaRAM.es
4.9. Sobredosis
Ya que su absorción es casi nula, es improbable cualquier intoxicación.
En sobredosis agudas con hidróxido de aluminio o combinaciones de sales de magnesio se han notificado
síntomas como diarrea, dolor abdominal y vómitos.
Dosis altas de este medicamento podrían desencadenar o agravar obstrucción intestinal y del íleo en
pacientes de riesgo como son pacientes con insuficiencia renal, alteraciones intestinales subyacentes, niños
menores de 2 años o pacientes de edad avanzada
Tanto el aluminio como el magnesio se eliminan por vía urinaria. El tratamiento en caso de sobredosis
aguda consiste en rehidratación y diuresis forzada. En caso de deficiencia de la función renal, sería
necesario realizar hemodiálisis o diálisis peritoneal.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: A gentes para el tratamiento de alteraciones causadas por ácidos.
Combinaciones y complejos de compuesto de aluminio, calcio y magnesio.
Código ATC: A02A D.
Los efectos de los antiácidos son debidos a la neutralización del ácido gástrico, consiguiendo el incremento
del pH gástrico por inhibición de la actividad de la pepsina que es máxima a pH 4. La capacidad para
neutralizar el ácido gástrico es de 11, 9 mEq por comprimido masticable y de 22,3 mEq por dos
comprimidos masticables.
5.2. Propiedades farmacocinéticas
La absorción de los iones aluminio, magnesio y calcio es casi nula y se eliminan por la orina. El resto, que
es la mayor parte de la dosis administrada, forma sales insolubles en el tracto intestinal que son excretadas
con las heces.
5.3. Datos preclínicos sobre seguridad
No se dispone de datos preclínicos.
6 . DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Povidona,
Manitol E-421 (101,5 mg/comprimido masticable),
Sacarina sódica,
Aroma de menta (que contiene maltodextrina: derivado de almidón de maíz),
Estearato magnésico,
Agua purificada.
6.2. Incompatibilidades
No procede.
6.3. Periodo de validez
24 meses.
6.4. Precauciones especiales de conservación
No conservar a temperatura superior a 30 ºC.
6.5. Naturaleza y contenido del envase
Estuche conteniendo 8 ó 50 comprimidos masticables dispuestos en blister de PVC/PVDC/Aluminio.
6.6. Precauciones especiales de eliminación y otras manipulaciones
Ninguna especial.
La eliminación de los productos no utilizados y de todos los materiales que hayan estado en contacto con
él, se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
ANGELINI PHARMA ESPAÑA, S.L.
c/ Antonio Machado, 78-80
3ª planta, módulo A-Edificio Australia
08840 Viladecans, Barcelona (España)
5 de 6
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
80048
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Julio 2015
10. FECHA DE LA REVISIÓN DEL TEXTO
Enero 2022
Resolvemos tus dudas
Sobre este producto o cualquier otro, no dudes en ponerte en contacto con nuestros farmacéuticos y farmacéuticas de Farmacia Senante Actur, Zaragoza.
¡Consúltanos!