Entregas 24/48 H (días hábiles)
Envios GRATIS desde 29.95 € (compra)
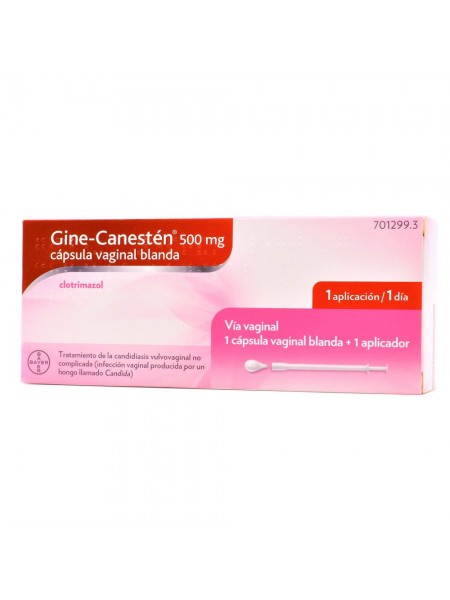
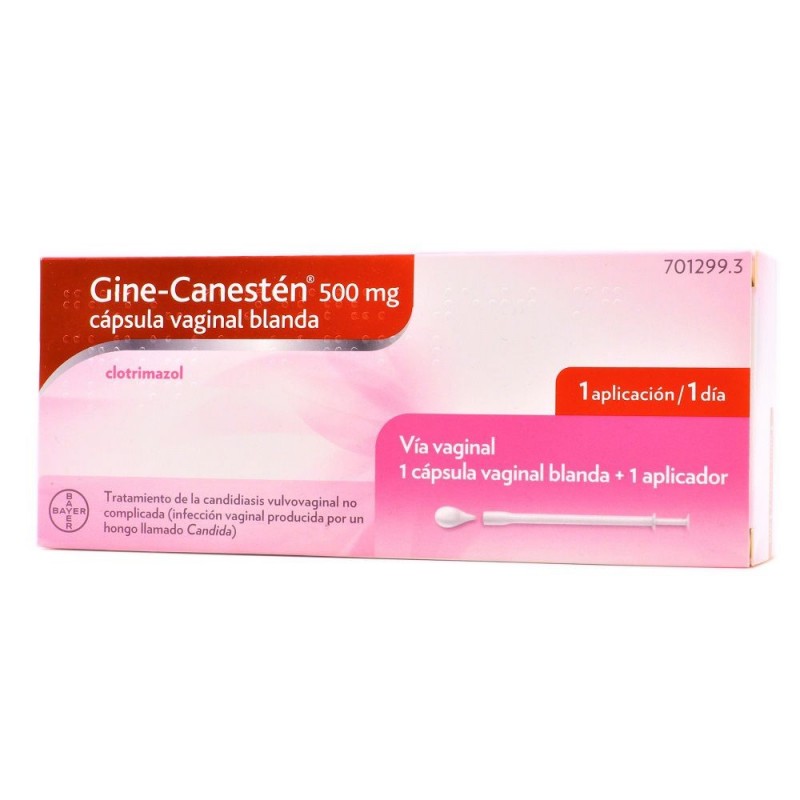
GINE-CANESTEN 500 MG 1 CAPSULA VAGINAL BLANDA
Gine - Canesten es un tratamiento de la candidiasis vulvovaginal no complicada
Deben tenerse en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antifúngicos.
¿Tienes dudas? te ayudamos en el 976 73 46 08
ENVÍOS 4.95€ --- GRATIS a partir de 29.95 € (compra)
Entregas 24/48 H (días hábiles)
Pago 100% seguro - Métodos de pago: 
Gine - Canesten es un tratamiento de la candidiasis vulvovaginal no complicada
Deben tenerse en cuenta las recomendaciones oficiales sobre el uso adecuado de agentes antifúngicos.
Referencias específicas
1. NOMBRE DEL MEDICAMENTO
Gine-Canestén 500 mg cápsula vaginal blanda
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada cápsula vaginal contiene 500 mg de clotrimazol
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Cápsula vaginal blanda.
Cápsula vaginal de color amarillo con forma de gota.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Tratamiento de la candidiasis vulvovaginal no complicada (ver sección 4.4) Deben tenerse en cuenta las
recomendaciones oficiales sobre el uso adecuado de agentes antifúngicos.
4.2. Posología y forma de administración
Posología
Adultos y adolescentes mayores de 12 años: Introducir una cápsula vaginal preferentemente por la noche
antes de acostarse. La cápsula vaginal debe ser introducida profundamente en la vagina (ver instrucciones
de uso del aplicador), estando la paciente acostada de espaldas y con las piernas ligeramente dobladas.
En aquellas mujeres cuyos síntomas persistan al finalizar el tratamiento o en caso de recurrencia a los dos
meses del primer episodio, se recomienda que el paciente acuda a su médico para evaluar posibles
patologías subyacentes.
Forma de administración
Vía vaginal
El médico debe valorar, en función de la extensión y de la localización de la infección, un tratamiento
adicional con antifúngicos de uso cutáneo en la zona vulvar.
Existen otras presentaciones disponibles.
Poblaciones especiales
Pacientes inmunocomprometidas (en tratamiento con corticoides orales, trasplantadas, con infección por
VIH o con diabetes mellitus)
Estas pacientes deben consultar con el médico antes de iniciar el tratamiento (ver sección 4.4).
Mujeres embarazadas
En caso de tratamiento en las últimas 4-6 semanas del embarazo, se recomienda no usar el aplicador
introduciéndose el cápsula vaginal directamente con el dedo, previo lavado cuidadoso de las manos (ver
sección 4.6).
INSTRUCCIONES DE USO
INSTRUCIONES PARA EL USO DEL
APLICADOR
1. Tirar del émbolo A hasta el tope.
Colocar la cápsula vaginal dentro del aplicador
2. Introducir el aplicador con la cápsula
vaginal lo más profundamente posible en la
vagina (mejor estando la paciente acostada).
3. Empujar el émbolo A hasta el tope, con lo
que la cápsula vaginal queda depositada en el
fondo de la vagina. Retirar el aplicador.
Advertencia
Las embarazadas deben seguir estrictamente
las instrucciones de su médico (ver secciones
4.2 y 4.6).
4.3. Contraindicaciones
Hipersensibilidad al clotrimazol, a cualquier otro antimicótico del grupo de los imidazoles o a alguno de los
excipientes incluidos en la sección 6.1.
4.4. Advertencias y precauciones especiales de empleo
No se recomienda el uso de este medicamento en mujeres inmunocomprometidas, tales como mujeres con
diabetes mellitus, con infección por VIH, SIDA, trasplantadas o en tratamiento con corticoides orales dado
que este grupo de población suelen presentar infección complicada que no responde bien a pautas de
tratamiento cortas.
En esta población además se ha descrito una mayor prevalencia de infecciones causadas por especies de
Candida no albicans . Se han descrito casos de disminución de la sensibilidad a azoles en candidiasis
vulvovaginal causada por estas especies de Candida no albicans. Este hecho debe tenerse en cuenta en el
tratamiento de infecciones causadas por estas especies, por ejemplo C. glabrata.
Se debe consultar a un médico si los síntomas empeoran durante el tratamiento o se mantienen después de 3
días o se observa aumento del flujo vaginal o cambios en su aspecto u olor, o sangrado.
Si el paciente tuviera fiebre (38ºC o más), dolor abdominal, dolor de lumbar o de espalda, secreciones
vaginales acuosas abundantes, náuseas y/o hemorragias vaginales, deberá evaluarse su situación clínica
para descartar otro tipo de patologías.
Si se produce alguna reacción de hipersensibilidad durante su utilización, deberá suspenderse el tratamiento
y se aplicarán las medidas terapéuticas adecuadas.
No se deben usar tampones, duchas intravaginales, espermicidas u otros productos vaginales mientras
utilice este medicamento.
No se recomienda iniciar el tratamiento durante la menstruación. El tratamiento debe haber finalizado antes
del inicio de la menstruación.
Se recomienda evitar las relaciones sexuales en caso de infección vaginal y mientras se usa este
medicamento para evitar que la pareja se infecte (ver sección 4.5). La pareja sexual también debe someterse
a tratamiento local si se presentan síntomas, por ejemplo, prurito, inflamación, etc.
Cuando se utilice durante el embarazo, la cápsula vaginal debe introducirse sin utilizar un aplicador (ver
sección Embarazo).
Este medicamento puede reducir la eficacia y la seguridad de los productos de látex, como condones y
diafragmas, cuando se aplica en el área genital (mujeres: por vía intravaginal, labios y área adyacente de la
vulva; los hombres: prepucio y glande del pene). Este efecto es temporal y aparece solo durante el
tratamiento.
4.5. Interacción con otros medicamentos y otras formas de interacción
El uso concomitante de clotrimazol vaginal junto con tacrolimus orales (FK-506; inmunosupresores)
podrían producir un aumento de los niveles plasmáticos de tacrolimus y similarmente con sirolimus. Los
pacientes deben ser monitorizados minuciosamente si aparecen los síntomas de sobredosis de tacrolimus o
sirolimus mediante el control de los niveles plasmáticos de los mismos.
4.6. Fertilidad, embarazo y lactancia
Embarazo:
Si bien existe una cantidad limitada de datos clínicos en mujeres embarazadas, los estudios en animales no
indican efectos perjudiciales directos o indirectos con respecto a la toxicidad reproductiva (ver Datos
preclínicos de seguridad).
Dado que la absorción de clotrimazol por vía vaginal es limitada (3-10%), no se esperan riesgos para la
madre y el niño, después del uso intravaginal de clotrimazol durante el embarazo.. El clotrimazol puede
utilizarse durante el embarazo, pero solo bajo la supervisión de un profesional sanitario.
En caso de tratamiento durante las últimas 4 ó 6 semanas del embarazo, se recomienda la inserción directa
de la cápsula con el dedo (ver sección 4.2) previo lavado cuidadoso de las manos.
Lactancia
No hay datos sobre la excreción de clotrimazol en la leche humana. Sin embargo, la absorción sistémica es
mínima tras la administración tópica y es poco probable que produzca efectos sistémicos. El clotrimazol
puede utilizarse durante la lactancia.
Fertilidad:
No se han realizado estudios en humanos sobre los efectos que puede producir el uso del clotrimazol en la
fertilidad, sin embargo, los estudios en animales no han demostrado ningún efecto adverso en la fertilidad
de los mismos (ver Datos preclínicos de seguridad).
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
La influencia de Gine-Canestén sobre la capacidad para conducir y utilizar máquinas es nula.
4.8. Reacciones adversas
Frecuencia no conocida. Las siguientes reacciones adversas han sido notificadas durante el uso posterior a
la comercialización de clotrimazol. Debido a que estas reacciones son notificadas voluntariamente por una
población de tamaño incierto, no puede estimarse su frecuencia a partir de los datos disponibles.
Las reacciones adversas más frecuentes son:
Trastornos del sistema inmunológico:
Angioedema, reacción anafiláctica, hipersensibilidad.
Trastornos vasculares:
Síncope, hipotensión.
Trastornos respiratorios, torácicos y mediastínicos:
Disnea.
Trastornos gastrointestinales:
Dolor abdominal, náuseas.
Trastornos de la piel y el tejido subcutáneo:
Erupción,, urticaria.
Trastornos del aparato reproductor y de la mama:
Descamación vaginal, flujo vaginal, prurito vulvovaginal, eritema vulvovaginal, molestias vulvovaginales,
sensación de quemazón vulvovaginal, dolor vulvovaginal y hemorragia vaginal.
Trastornos generales y en el lugar de administración:
Irritación del lugar de aplicación, edema, dolor.
Estos síntomas no suelen determinar la supresión del tratamiento y son más frecuentes durante los primeros
días del mismo.
Notificación de sospechas de reacciones adversas:
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite
una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales
sanitarios a notificar las sospechas de reacciones adversas a través del Sistema Español de
Farmacovigilancia de Medicamentos de Uso Humano: https://www.notificaram.es
4.9. Sobredosis
El riesgo de intoxicación aguda o sobredosis es poco probable que ocurra después de una sola
administración vaginal (mediante aplicación cutánea sobre una gran superficie en condiciones favorables
para la absorción) o la ingestión oral inadvertida, según proceda. Una ingestión accidental puede provocar
molestias gastrointestinales y/o vómitos. No existe un antídoto específico.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Derivados imidazólicos y triazólicos, código ATC:
G01AF02
El clotrimazol es un antifúngico derivado del grupo imidazol.
Mecanismo de acción
El clotrimazol impide el crecimiento de hongos actuando a nivel de la síntesis del ergosterol. La inhibición
de la síntesis del ergosterol provoca la alteración estructural y funcional de la membrana citoplasmática,
dando lugar a un cambio en la permeabilidad de la membrana que finalmente provoca la lisis celular.
El clotrimazol es un antifúngico de amplio espectro, con actividad in vitro e in vivo, frente a dermatofitos,
levaduras y mohos.
En condiciones de estudio adecuadas, los valores de la concentración mínima inhibitoria (CMI) para estas
especies de hongos están entre 0,062 y 8 μg/ml de substrato. In vitro, el clotrimazol ha demostrado ser
fungistático o fungicida dependiendo de la concentración. Actúa como fungistático a concentraciones
iguales a las CMI, y como fungicida cuando estas concentraciones son aproximadamente 5 veces las CMI.
Resistencia
Las variantes de resistencia primaria de las especies fúngicas sensibles son poco frecuentes. Hasta el
momento, el desarrollo de resistencia secundaria en cepas sensibles sólo se ha observado en casos muy
aislados bajo condiciones terapéuticas.
5.2. Propiedades farmacocinéticas
Las investigaciones farmacocinéticas tras la administración cutánea han demostrado que sólo se absorbe
una pequeña cantidad de clotrimazol en sangre. Las concentraciones séricas resultantes están siempre por
debajo del límite de detección (< 10 ng/ml) y no provocan efectos sistémicos.
5.3. Datos preclínicos sobre seguridad
Los datos preclínicos obtenidos en estudios convencionales de seguridad farmacológica, toxicidad de dosis
repetidas, genotoxicidad y potencial carcinogénico no muestran riesgos especiales para el tratamiento de
seres humanos con clotrimazol por vía vaginal.
En un estudio de fertilidad en ratas se observó una reducción de la supervivencia neonatal en el grupo
tratado con 50 mg/kg de peso corporal de clotrimazol, pero dosis de hasta 25 mg/kg de peso corporal no
perjudicaron el desarrollo de las crías. Clotrimazol no afectó a la fertilidad.
No se demostraron efectos de teratogenicidad en ratones, conejos y ratas que recibieron dosis orales de
hasta 200, 180, y 100 mg/kg, respectivamente.
Un estudio con ratas lactantes que recibieron clotrimazol por vía intravenosa mostró que los niveles de
clotrimazol en leche son de 10 a 20 veces superiores a los plasmáticos 4 horas tras la administración y que
estos disminuyen a 0.4 veces los niveles en plasma a las 24 horas.
6 . DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Parafina blanca blanda
Parafina líquida
Gelatina
Glicerol (E-422)
Agua purificada
Dióxido de titanio (E-171)
Amarillo de quinoleina (E-104)
Amarillo anaranjado S (E-110)
Lecitina
Triglicéridos de cadena media
6.2. Incompatibilidades
No procede.
6.3. Periodo de validez
3 años.
6.4. Precauciones especiales de conservación
Conservar en el envase original para protegerlo de la humedad
6.5. Naturaleza y contenido del envase
Envase con 1 cápsula vaginal en blíster de aluminio y un aplicador.
6.6. Precauciones especiales de eliminación y otras manipulaciones
La eliminación del medicamento no utilizado y de todos los materiales que hayan estado en contacto con él,
se realizará de acuerdo con la normativa local.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
BAYER HISPANIA, S.L.
Av. Baix Llobregat, 3-5
08970 Sant Joan Despí (Barcelona)
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
78.414
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 31.01.2014
Fecha de la renovación de la autorización: 31.01.2019
10. FECHA DE LA REVISIÓN DEL TEXTO
03/2022
La información detallada y actualizada de este medicamento está disponible en la página Web de la
Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) http://www.aemps.gob.es/
Resolvemos tus dudas
Sobre este producto o cualquier otro, no dudes en ponerte en contacto con nuestros farmacéuticos y farmacéuticas de Farmacia Senante Actur, Zaragoza.
¡Consúltanos!