Entregas 24/48 H (días hábiles)
Envios GRATIS desde 29.95 € (compra)
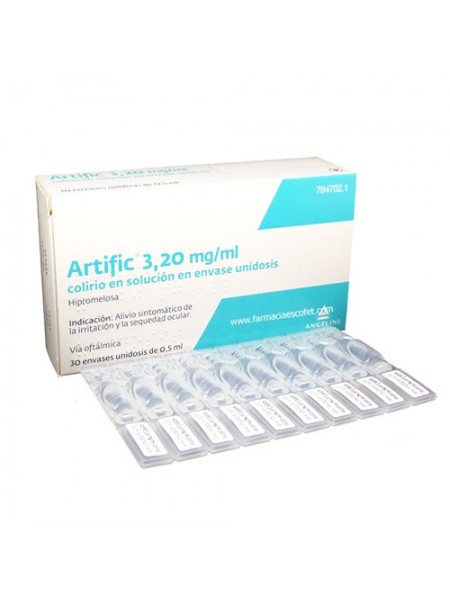
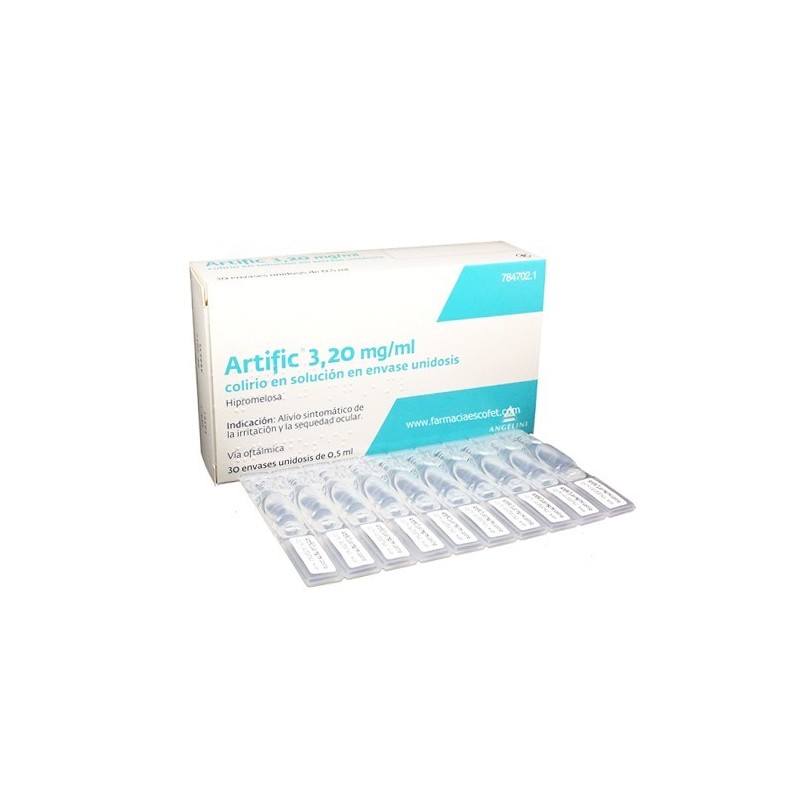
ARTIFIC 3,2 MG/ML COLIRIO EN SOLUCION 30 MONODOSIS 0,5 ML
Artific es un colirio que alivia los síntomas de la sequedad e irritación ocular
¿Tienes dudas? te ayudamos en el 976 73 46 08
ENVÍOS 4.95€ --- GRATIS a partir de 29.95 € (compra)
Entregas 24/48 H (días hábiles)
Pago 100% seguro - Métodos de pago: 
Artific es un colirio que alivia los síntomas de la sequedad e irritación ocular
Referencias específicas
1. NOMBRE DEL MEDICAMENTO
Artific 3,20 mg/ml colirio en solución.
Artific 3,20 mg/ml colirio en solución en envase unidosis.
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
1 ml de colirio en solución contiene 3,20 mg de hipromelosa (methocel F4M).
Excipientes con efecto conocido: hidrógeno fosfato de sodio dodecahidrato y dihidrógeno fosfato de sodio dihidrato.
Artific 3,20 mg/ml colirio en solución contiene 0,051 mg de fosfatos en cada gota, lo que equivale a 1,84 mg/ml.
Artific 3,20 mg/ml colirio en solución en envase unidosis contiene 0,068 mg de fosfatos en cada gota, lo que equivale a 1,84 mg/ml.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Colirio en solución.
Solución incolora, transparente y sin partículas visibles.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas
Alivio sintomático de la irritación y la sequedad ocular.
4.2. Posología y forma de administración
Posología
Ambos medicamentos se administran por vía oftálmica.
Instilar una gota en el saco conjuntival 3 a 5 veces al día o, si fuera necesario, más frecuentemente. El tratamiento del síndrome del ojo seco requiere un régimen individualizado de dosificación.
Artific 3,20 mg/ml colirio en solución en envase unidosis no contiene conservante y, por consiguiente, no debe guardarse tras su apertura. Desechar el contenido restante del frasco unidosis después de cada aplicación.
4.3. Contraindicaciones
Hipersensibilidad al principio activo o a cualquiera de los excipientes incluidos en la sección 6.1.
4.4. Advertencias y precauciones especiales de empleo
Cualquier medicación oftalmológica concomitante debe administrarse 5 minutos antes de la instilación de Artific.
Si se produce irritación, dolor, enrojecimiento o cambios en la visión, o si los síntomas del paciente empeoran o perduran más de 7 días, se debe interrumpir el tratamiento y hacer una nueva evaluación.
Los portadores de lentes de contacto blandas deberán extraérselas antes de la administración de Artific 3,20 mg/ml colirio en solución y esperar como mínimo 15 minutos para colocárselas de nuevo.
En el caso de Artific 3,20 mg/ml colirio en solución en envase unidosis, por no contener conservante, los portadores de lentes de contacto blandas no necesitan extraérselas antes de su administración.
4.5. Interacción con otros medicamentos y otras formas de interacción
En aplicación intraocular, no se han descrito, hasta la fecha, interacciones con otros fármacos.
4.6. Fertilidad, embarazo y lactancia
No existe experiencia respecto a la seguridad de este producto durante el embarazo o la lactancia.
4.7. Efectos sobre la capacidad para conducir y utilizar máquinas
No procede.
4.8. Reacciones adversas
Todas las reacciones adversas notificadas, hasta la fecha, han tenido lugar en la zona ocular, ya que la preparación no penetra y, por tanto, no se absorbe.
Trastornos oculares:
Poco frecuentes (de ≥1/1.000 a <1/100): sensación de quemazón, visión borrosa y adhesividad palpebral.
Se han notificado, de forma muy rara, casos de calcificación corneal asociados al uso de colirios que contienen fosfatos en algunos pacientes con las córneas dañadas de forma significativa.
Notificación de sospechas de reacciones adversas
Es importante notificar sospechas de reacciones adversas al medicamento tras su autorización. Ello permite una supervisión continuada de la relación beneficio/riesgo del medicamento. Se invita a los profesionales sanitarios a notificar sospechas de reacciones adversas a través del Sistema Español de Farmacovigilancia de Medicamentos de Uso Humano: https:// www.notificaram.es
4.9. Sobredosis
No se han notificado casos de sobredosis.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas
Grupo farmacoterapéutico: Lágrimas artificales y otros preparados inertes, código ATC: S01XA20
La hipromelosa es una celulosa parcialmente metilada e hidroxipropilada. En el ojo sano, la superficie de la córnea está principalmente humedecida por la mucina que se produce en la conjuntiva. La mucina es absorbida en la superficie de la córnea y forma una superficie hidrofílica. En casos de sequedad ocular, y particularmente de deficiencia de mucina, está indicada la administración de una lágrima artificial. Es importante su actividad en la superficie y su capacidad de adsorción, por eso, la hipromelosa es particularmente adecuada en estos casos. La hipromelosa tiene una acción físico-química y produce, en solución acuosa, la reducción de la tensión superficial así como un incremento de la viscosidad. La hipromelosa se adhiere bien a la córnea y a la conjuntiva y proporciona una adecuada humectación. Los síntomas de irritación causados por parpadeo cuando existe deficiencia de fluido lagrimal son, de este modo, disminuidos y se previenen los consecuentes síntomas de la desecación epitelial.
5.2. Propiedades farmacocinéticas
Varios autores han estudiado la farmacocinética sistémica de la hipromelosa en conejos de Indias, perros y conejos, y han demostrado que no se produce absorción en los tejidos.
5.3. Datos preclínicos sobre seguridad
Los estudios in vitro realizados para estudiar la citotoxicidad han demostrado que la hipromelosa es muy bien tolerada en córneas humanas y de animales de origen bovino. En los ensayos realizados en conejos de Indias, no se detectó ninguna sensibilización potencial.
Se realizó un ensayo de mutagenicidad bacteriana (ensayo de Ames) para determinar el potencial mutagénico y el resultado fue negativo. Aunque la evaluación de este riesgo potencial no es posible sólo con este estudio, la mutagenicidad potencial puede ser excluida debido, en gran medida, a la actual estructura química.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes
Artific 3,20 mg/ml colirio en solución:
Cetrimida
Hidrógeno fosfato de sodio dodecahidrato
Dihidrógeno fosfato de sodio dihidrato
Edetato disódico
Sorbitol (E420)
Agua para inyectables
Artific 3,20 mg/ml colirio en solución en envase unidosis:
Hidrógeno fosfato de sodio dodecahidrato
Dihidrógeno fosfato de sodio dihidrato
Sorbitol (E420)
Agua para inyectables
6.2. Incompatibilidades
No procede.
6.3. Periodo de validez
Artific 3,20 mg/ml colirio en solución: 3 años.
Desechar el colirio sobrante a las 6 semanas de la primera apertura del frasco.
Artific 3,20 mg/ml colirio en solución en envase unidosis: 2 años.
Desechar el contenido restante del frasco unidosis después de cada aplicación.
6.4. Precauciones especiales de conservación
Artific 3,20 mg/ml colirio en solución: No almacenar a temperatura superior a 30ºC.
Artific 3,20 mg/ml colirio en solución en envase unidosis: No almacenar a temperatura superior a 25ºC.
6.5. Naturaleza y contenido del envase
Artific 3,20 mg/ml colirio en solución: frasco gotero de plástico tipo LDPE de 10 ml.
Artific 3,20 mg/ml colirio en solución en envase unidosis: 30 envases unidosis de plástico tipo LDPE de 0,5 ml.
6.6. Precauciones especiales de eliminación y otras manipulaciones
No procede.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Bausch & Lomb S.A.
Avda., Valdelaparra, 4
28108 – Alcobendas, Madrid
España
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
Artific 3,20 mg/ml colirio en solución: 65.810
Artific 3,20 mg/ml colirio en solución en envase unidosis: 65.809
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Diciembre 2003 / Junio 2008
Resolvemos tus dudas
Sobre este producto o cualquier otro, no dudes en ponerte en contacto con nuestros farmacéuticos y farmacéuticas de Farmacia Senante Actur, Zaragoza.
¡Consúltanos!